ਰਸਾਇਣਕ ਯੋਗ
ਦਿੱਖ
(ਰਸਾਇਣਕ ਯੋਗਕ ਤੋਂ ਮੋੜਿਆ ਗਿਆ)
 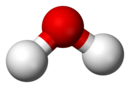 | |
| ਉੱਪਰ ਤਸਵੀਰ ਵਿੱਚ ਸ਼ੁੱਧ ਪਾਣੀ (H2O) ਜੋ ਇੱਕ ਯੋਗ ਦੀ ਮਿਸਾਲ ਹੈ: ਇਸਦੇ ਅਣੂ ਦਾ ਖਿੱਦੋ-ਤੀਲੀ ਨਮੂਨਾ (ਉੱਤੇ) ਜੋ ਵਿਖਾਉਂਦਾ ਹੈ ਕਿ ਕਿਵੇਂ ਪਾਣੀ ਦੋ ਹਿੱਸੇ ਹਾਈਡਰੋਜਨ ਅਤੇ ਇੱਕ ਹਿੱਸਾ ਆਕਸੀਜਨ ਦਾ ਬਣਿਆ ਹੁੰਦਾ ਹੈ |
ਰਸਾਇਣਕ ਯੋਗ ਇੱਕ ਸ਼ੁੱਧ ਰਸਾਇਣਕ ਪਦਾਰਥ ਹੁੰਦਾ ਹੈ ਜਿਸਦੇ ਵਿੱਚ ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਵੱਖ-ਵੱਖ ਰਸਾਇਣਕ ਤੱਤ ਹੁੰਦੇ ਹਨ[1][2][3] ਅਤੇ ਜਿਸਨੂੰ ਰਸਾਇਣਕ ਕਿਰਿਆਵਾਂ ਰਾਹੀਂ ਸਰਲ ਪਦਾਰਥਾਂ ਵਿੱਚ ਨਿਖੇੜਿਆ ਜਾ ਸਕਦਾ ਹੈ।[4] ਰਸਾਇਣਕ ਯੋਗਾਂ ਦਾ ਇੱਕ ਵਿਲੱਖਣ ਅਤੇ ਨਿਸ਼ਚਿਤ ਰਸਾਇਣਕ ਢਾਂਚਾ ਹੁੰਦਾ ਹੈ; ਇਹਨਾਂ ਵਿੱਚ ਪਰਮਾਣੂਆਂ ਦਾ ਇੱਕ ਨਿਸ਼ਚਿਤ ਅਨੁਪਾਤ ਹੁੰਦਾ ਹੈ[3] ਜੋ ਰਸਾਇਣਕ ਜੋੜਾਂ ਰਾਹੀਂ ਇੱਕ ਖ਼ਾਸ ਇੰਤਜ਼ਾਮ ਵਿੱਚ ਬੱਝੇ ਰਹਿੰਦੇ ਹਨ। ਰਸਾਇਣਕ ਯੋਗ ਸਹਿ-ਸੰਯੋਜਕ ਜੋੜਾਂ ਰਾਹੀਂ ਬੱਝੇ ਅਣਵੀ ਯੋਗ, ਬਿਜਲਾਣੂ ਜੋੜਾਂ ਰਾਹੀਂ ਬੱਝੇ ਲੂਣ, ਧਾਤੀ ਜੋੜਾਂ ਰਾਹੀਂ ਬੱਝੇ ਅੰਤਰਧਾਤੀ ਯੋਗ ਜਾਂ ਸਹਿਕਾਰ ਸਹਿ-ਸੰਯੋਗ ਜੋੜਾਂ ਰਾਹੀਂ ਬੱਝੇ ਕੰਪਲੈਕਸ ਹੋ ਸਕਦੇ ਹਨ। ਖ਼ਰੇ ਰਸਾਇਣਕ ਤੱਤਾਂ ਨੂੰ ਰਸਾਇਣਕ ਯੋਗ ਨਹੀਂ ਗਿਣਿਆ ਜਾਂਦਾ ਭਾਵੇਂ ਉਹ ਸਿਰਫ਼ ਇੱਕੋ ਤੱਤ ਦੇ ਕਈ ਪਰਮਾਣੂਆਂ ਵਾਲ਼ੇ ਅਣੂਆਂ ਦੇ ਬਣੇ ਹੋਣ (ਜਿਵੇਂ ਕਿ H2, S8, etc.)।[5]
ਹਵਾਲੇ
[ਸੋਧੋ]- ↑ Brown, Theodore L.; LeMay, H. Eugene; Bursten, Bruce E.; Murphy, Catherine J.; Woodward, Patrick (2009), Chemistry: The Central Science, AP Edition (11th ed.), Upper Saddle River, NJ: Prentice Hall, pp. 5–6, ISBN 0-13-236489-1
- ↑ Hill, John W.; Petrucci, Ralph H.; McCreary, Terry W.; Perry, Scott S. (2005), General Chemistry (4th ed.), Upper Saddle River, NJ: Prentice Hall, p. 6, ISBN 978-0-13-140283-6
- ↑ 3.0 3.1 Whitten, Kenneth W.; Davis, Raymond E.; Peck, M. Larry (2000), General Chemistry (6th ed.), Fort Worth, TX: Saunders College Publishing/Harcourt College Publishers, p. 15, ISBN 978-0-03-072373-5
- ↑ Wilbraham, Antony; Matta, Michael; Staley, Dennis; Waterman, Edward (2002), Chemistry (1st ed.), Upper Saddle River, NJ: Prentice Hall, p. 36, ISBN 0-13-251210-6
- ↑ Halal, John (2008), "Chapter 8: General Chemistry", Milady's Hair Structure and Chemistry Simplified (5 ed.), Milady Publishing, pp. 96–98, ISBN 1-4283-3558-7
{{citation}}: External link in|chapterurl=|chapterurl=ignored (|chapter-url=suggested) (help)
