ਪਰਮਾਣੂ
| ਹੀਲੀਅਮ ਐਟਮ | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| ਹੀਲੀਅਮ ਐਟਮ ਦਾ ਚਿੱਤਰ, ਜਿਸ ਵਿੱਚ ਨਿਊਕਲੀ (ਗੁਲਾਬੀ) ਅਤੇ ਬਿਜਲਾਣੂ ਬੱਦਲ ਵਿਤਰਣ (ਕਾਲਾ) ਦਰਸਾਇਆ ਹੈ। ਹੀਲੀਅਮ-4 ਦੀ ਨਿਊਕਲੀ (ਉੱਪਰ ਸੱਜੇ) ਦਰਅਸਲ ਗੋਲਾਕਾਰੀ ਤੌਰ ਤੇ ਸਮਿਟਰੀਗਤ ਹੈ ਅਤੇ ਬਿਜਲਾਣੂ ਬੱਦਲ ਨਾਲ ਨੇੜਿਉਂ ਸਗਵੀਂ ਹੈ, ਭਾਵੇਂ ਵਧੇਰੇ ਜਟਿਲ ਨਿਊਕਲੀਆਂ ਹਮੇਸ਼ਾ ਇਹ ਗੱਲ ਨਹੀਂ ਹੁੰਦੀ। ਬਲੈਕ ਬਾਰ ਇੱਕ ਐਂਗਸਟੋਰਮ ਹੈ (10−10 ਮੀਟਰ or 100 pm)। | ||||||||
| ਵਰਗੀਕਰਨ | ||||||||
| ||||||||
| ਗੁਣ | ||||||||
|
ਪਰਮਾਣੂ (ਸੰਸਕ੍ਰਿਤ: परमाणु, ਅੰਗਰੇਜ਼ੀ: atom) ਮਾਦਾ ਦੀ ਮੂਲ ਇਕਾਈ ਹੈ ਜਿਸ ਵਿੱਚ ਇੱਕ ਸੰਘਣਾ ਨਿਊਕਲੀਅਸ(ਕੇਂਦਰ) ਹੁੰਦਾ ਹੈ ਜਿਸ ਦੇ ਆਲੇ-ਦੁਆਲੇ ਇਲੈਕਟ੍ਰਾਨਾਂ ਦਾ ਨੈਗੇਟਿਵ ਚਾਰਜ ਵਾਲਾ ਬੱਦਲ ਹੁੰਦਾ ਹੈ। ਹਾਈਡ੍ਰੋਜਨ ਨੂੰ ਛੱਡ ਕੇ ਹਰ ਤੱਤ (ਐਲੀਮੈਂਟ)0ਦੇ ਨਿਊਕਲੀਅਸ ਵਿੱਚ ਪਾਜ਼ੀਟਿਵ ਚਾਰਜ ਵਾਲੇ ਪ੍ਰੋਟਾਨ ਅਤੇ ਨਿਊਟ੍ਰਲ ਚਾਰਜ ਵਾਲੇ ਨਿਊਟ੍ਰਾਨ ਹੁੰਦੇ ਹਨ। ਇਲੈਕਟ੍ਰੋਮੈਗਨੇਟਿਕ ਬਲ ਇਲੈਕਟ੍ਰਾਨਾ ਨੂੰ ਨਿਊਕਲੀਅਸ ਨਾਲ ਬੰਨ੍ਹ ਕੇ ਰੱਖਦਾ ਹੈ ਅਤੇ ਨਿਊਕਲੀਅਸ ਵਿਚਾਲੇ ਸਟ੍ਰਾਂਗ ਬਲ ਪ੍ਰੋਟਾਨਾਂ ਨੂੰ ਆਪਸ ਵਿੱਚ ਜੋੜੀ ਰੱਖਦਾ ਹੈ।[1]
ਐਟਮ ਦੋ ਲਫ਼ਜ਼ਾਂ ਤੋਂ ਬਣਿਆ ਹੈ, "ἄτομος"—ਐਟਮੌਸ (α-, "ਅਨ-" + τέμνω - ਟੈਮਨੋ, "ਕੱਟਣਾ"), ਜਿਸ ਦਾ ਮਤਲਬ ਹੈ ਨਾ ਕੱਟਿਆ ਜਾਂ ਵੰਡਿਆ ਜਾਣ ਵਾਲਾ। ਮਾਦੇ ਦੀ ਨਾ ਵੰਡੀ ਜਾਣ ਵਾਲੀ ਇਕਾਈ ਵਜੋਂ ਸਭ ਤੋਂ ਪਹਿਲਾਂ ਐਟਮ ਨੂੰ ਭਾਰਤੀ ਅਤੇ ਗ੍ਰੀਕ ਫ਼ਿਲਾਸਫ਼ਰਾਂ ਨੇ ਮੰਨਿਆ। 17ਵੀਂ ਅਤੇ 18ਵੀਂ ਸਦੀ ਦੌਰਾਨ ਸਾਇੰਸਦਾਨਾਂ ਨੇ ਵਿਖਾਇਆ ਕਿ ਮਾਦੇ ਨੂੰ ਰਸਾਇਣਕ ਤਰੀਕਿਆਂ ਰਾਹੀਂ ਤੋੜਿਆ ਜਾ ਸਕਦਾ ਹੈ।19ਵੀਂ ਅਤੇ 20ਵੀਂ ਸਦੀ ਦੌਰਾਨ ਸਾਇੰਸਦਾਨਾਂ ਨੇ ਐਟਮ ਬਣਾਉਣ ਵਾਲੀਆਂ ਇਕਾਈਆਂ ਦੀ ਖੋਜ ਕਰ ਕੇ ਸਿੱਧ ਕੀਤਾ ਕਿ ਐਟਮ ਮੂਲ ਰੂਪ ਵਿੱਚ ਨਾ-ਟੁੱਟਣਯੋਗ ਨਹੀਂ ਹੈ। ਇਸ ਤੋਂ ਬਾਅਦ ਕੁਆਂਟਮ ਸਿਧਾਂਤ ਦਾ ਜਨਮ ਹੋਇਆ।[2]
ਵਿਗਿਆਨਕ ਸਿਧਾਂਤ ਦੀ ਉਤਪਤੀ
[ਸੋਧੋ]
1789 ਵਿੱਚ, ਫ਼ਰਾਂਸੀਸੀ ਸਾਇੰਸਦਾਨ ਐਨਟੋਨੀ ਲੈਵੋਇਜ਼ੀਅਰ ਨੇ ਰਸਾਇਣਕ-ਭਾਰ ਦੇ ਸੰਭਾਲ ਦਾ ਨੇਮ ਪ੍ਰਕਾਸ਼ਿਤ ਕੀਤਾ।[3]
1803 ਵਿੱਚ, ਅੰਗਰੇਜ਼ੀ ਫ਼ਿਲਾਸਫ਼ਰ ਅਤੇ ਸਾਇੰਸਦਾਨ ਜੌਹਨ ਡਾਲਟਨ ਨੇ ਪਰਮਾਣੂ ਦਾ ਸਿਧਾਂਤ ਵਰਤ ਕੇ ਦਰਸਾਇਆ ਕਿ ਰਸਾਇਣਕ ਪ੍ਰਤੀਕਿਰਿਆਵਾਂ(chemical reaction) ਕਿਵੇਂ ਵਰਤਦੀਆਂ ਹਨ।[4][5][6]
ਇਸ ਸਿਧਾਂਤ ਨੂੰ ਵਧੇਰੇ ਨਰੋਆਪਣ 1827 ਵਿੱਚ ਰੌਬਰਟ ਬ੍ਰਾਊਨ ਦੇ 'ਬ੍ਰਾਓਨੀਅਨ ਮੋਸ਼ਨ' ਦੀ ਵਿਆਖਿਆ ਨੇ ਦਿੱਤਾ। ਜੇ.ਡੇਸੌਲਕਸ ਨੇ 1877 ਵਿੱਚ ਇਹ ਵਿਚਾਰ ਦਿੱਤਾ ਕਿ ਇਹ ਵਰਤਾਰਾ ਤਾਪ-ਬਲ ਕਰ ਕੇ ਹੁੰਦਾ ਹੈ ਅਤੇ 1905 ਵਿੱਚ ਐਲਬਰਟ ਆਈਨਸਟਾਈਨ ਨੇ ਇਸ ਨੂੰ ਹਿਸਾਬ ਦੀ ਵਰਤੋਂ ਕਰ ਕੇ ਸਿੱਧ ਕੀਤਾ।[7][8][9] ਫ਼੍ਰਾਂਸੀਸੀ ਭੌਤਿਕ ਵਿਗਿਆਨੀ, ਜੀਨ ਪੈਰਿਨ ਨੇ ਡਾਲਟਨ ਵੱਲੋਂ ਦਿੱਤੇ ਸਿਧਾਂਤ ਨੂੰ ਪ੍ਰਯੋਗਾਤਮਕ ਤਰੀਕੇ ਨਾਲ ਸਿੱਧ ਕੀਤਾ।[10]

ਪਹਿਲੀਆਂ ਖੋਜਾਂ ਦੇ ਆਧਾਰ ਉੱਤੇ 1869 ਵਿੱਚ ਦਮਿਤਰੀ ਮੈਂਡਲਈਵ ਨੇ ਪਹਿਲਾ ਪੀਰੀਆਡਿਕ ਟੇਬਲ ਬਣਾਇਆ।[11][12]
ਥਾਮਸਨ ਦਾ ਪਰਮਾਣੂ ਮਾਡਲ
[ਸੋਧੋ]ਜੇ. ਜੇ. ਥਾਮਸਨ ਨੇ ਪਰਮਾਣੂ ਦੀ ਬਣਤਰ ਨਾਲ ਸਬੰਧਿਤ ਮਾਡਲ ਪੇਸ਼ ਕੀਤਾ, ਜੋ ਕਰਿਸਮਸ ਕੇਕ ਵਾਂਗ ਸੀ। ਇਨ੍ਹਾਂ ਦੇ ਅਨੁਸਾਰ ਪਰਮਾਣੂ ਇੱਕ ਧਨ-ਚਾਰਜਿਤ ਗੋਲਾ ਸੀ, ਜਿਸ ਵਿੱਚ ਇਲੈਕਟ੍ਰਾੱਨ ਲੱਗੇ ਹੋਏ ਸਨ। ਤਰਬੂਜ ਦੀ ਉਦਾਹਰਨ ਜਿਸ ਵਿੱਚ ਪਰਮਾਣੂ ਵਿੱਚ ਧਨ-ਚਾਰਜ ਤਰਬੂਜ ਦੇ ਖਾਣ ਵਾਲੇ ਲਾਲ ਭਾਗ ਵਾਂਗ ਖਿਲਰਿਆ ਹੈ, ਜਦ ਕਿ ਇਲੈਕਟ੍ਰਾੱਨ ਧਨ ਚਾਰਜਿਤ ਗੋਲੇ ਵਿੱਚ ਤਰਬੂਜ ਦੇ ਬੀਜ ਵਾਂਗ ਖੁੱਭੇ ਹਨ।
ਸੁਝਾਅ
[ਸੋਧੋ]- ਪ੍ਰਮਾਣੂ ਧਨ-ਚਾਰਜਿਤ ਗੋਲੇ ਦ ਬਣਿਆ ਹੋਇਆ ਹੈ ਅਤੇ ਰਿਣ ਚਾਰਜਿਤ ਇਲੈਕਟ੍ਰਾੱਨ ਉਸ ਵਿੱਚ ਖੁੱਭੇ ਹੁੰਦ ਹਨ।
- ਰਿਣਾਤਮਕ ਅਤੇ ਧਨਾਤਮਕ ਚਾਰਜ ਮਾਤਰਾ ਵਿੱਚ ਸਮਾਨ ਹੁੰਦੇ ਹਨ ਇਸਲਈ ਪਰਮਾਣੂ ਬਿਜਲਈ ਰੂਪ ਵਿੱਚ ਉਦਾਸੀਨ ਹੁੰਦੇ ਹਨ।
ਕੁਆਂਟਮ ਸਿੱਧਾਂਤ
[ਸੋਧੋ]ਜੇ.ਜੇ.ਥੌਮਸਨ ਨੇ ਕੈਥੋਡ ਕਿਰਨਾਂ ਉੱਪਰ ਕੀਤੀ ਸੋਧ ਦੇ ਆਧਾਰ ਉੱਤੇ 1897 ਵਿੱਚ ਇਲੈਕਟ੍ਰਾਨ ਦੀ ਖੋਜ ਕੀਤੀ।[13] 1909 ਵਿੱਚ ਗੀਗਰ ਅਤੇ ਮਾਰਸ਼ਡੈਨ ਨੇ ਅਰਨਸਟ ਰੁਦਰਫ਼ੋਰਡ ਦੀ ਅਗਵਾਈ ਹੇਠ ਪਰਮਾਣੂ ਦਾ ਰੁਦਰਫ਼ੋਰਡ ਮਾਡਲ ਦਿੱਤਾ।[14]
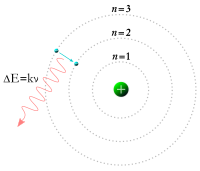
1913 ਵਿੱਚ ਨੀਲ ਬੋਹਰ ਨੇ ਦੱਸਿਆ ਕਿ ਇਲੈਕਟ੍ਰਾਨ ਨੂੰ ਨਿਊਕਲੀਅਸ ਦੁਆਲੇ ਨਿਸ਼ਚਤ ਬਲ ਵਾਲੀਆਂ ਔਰਬਿਟ ਮੁਹੱਈਆ ਕੀਤੀਆਂ ਗਈਆਂ ਹਨ।[15] 1932 ਵਿੱਚ ਚਾਡਵਿਕ ਨੇ ਨਿਊਕਲੀਅਸ ਵਿਚਲੇ ਨਿਊਟ੍ਰਾਨ ਦੀ ਖੋਜ ਕੀਤੀ।[16]
ਹਵਾਲੇ
[ਸੋਧੋ]- ↑ Slaven, Dave. "What holds an atom together?".
- ↑ Harrison (2003:123–139).
- ↑ "Lavoisier's Elements of Chemistry". Elements and Atoms. Le Moyne College, Department of Chemistry. Retrieved 2007-12-18.
- ↑ Wurtz (1881:12).
- ↑ Dalton (1808).
- ↑ Nakli itihaas jo likheya geya hai kade na vaapriya jo ohna de base te, saade te saada itihaas bna ke ehna ne thop dittiyan. anglo sikh war te ek c te 3-4 jagaha te kiwe chal rahi c ikko war utto saal 1848 jdo angrej sara punjab 1845 ch apne under kar chukke c te oh 1848 ch kihna nal jang ladd rahe c. Script error: The function "citation198.168.27.221 14:54, 13 ਦਸੰਬਰ 2024 (UTC)'"`UNIQ--ref-00000016-QINU`"'</ref>" does not exist.
- ↑ Einstein, Albert (1905). "Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen" (PDF). Annalen der Physik (in German). 322 (8): 549–560. doi:10.1002/andp.19053220806. Archived from the original (PDF) on 2007-07-18. Retrieved 2007-02-04.
{{cite journal}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help)CS1 maint: unrecognized language (link) - ↑ Mazo (2002:1–7).
- ↑ Lee, Y.K. (1995). "Brownian Motion". Imperial College. Archived from the original on 2007-12-18. Retrieved 2007-12-18.
{{cite web}}: Unknown parameter|coauthors=ignored (|author=suggested) (help); Unknown parameter|dead-url=ignored (|url-status=suggested) (help) - ↑ Patterson, G. (2007). "Jean Perrin and the triumph of the atomic doctrine". Endeavour. 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003.
- ↑ "Periodic Table of the Elements". The International Union of Pure and Applied Chemistry. November 1, 2007. Retrieved 2010-05-14.
- ↑ Scerri (2007:10–17).
- ↑ "J.J. Thomson". Nobel Foundation. 1906. Retrieved 2007-12-20.
- ↑ Rutherford, E. (1911). "The Scattering of α and β Particles by Matter and the Structure of the Atom" (PDF). Philosophical Magazine. 21: 669–88.[permanent dead link]
- ↑ Stern, David P. (16 May 2005). "The Atomic Nucleus and Bohr's Early Model of the Atom". NASA/Goddard Space Flight Center. Archived from the original on 2007-08-20. Retrieved 2007-12-20.
{{cite web}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help) - ↑ Chadwick, James (12 December 1935). "Nobel Lecture: The Neutron and Its Properties". Nobel Foundation. Retrieved 2007-12-21.
<ref> tag defined in <references> has no name attribute.